افزایش سریع مصرف انرژی در سطح جهانی و اثرات زیست محیطی منابع انرژی سنتی، چالش های جدی را برای سلامتی انسان، امنیت انرژی و حفاظت از محیط زیست مطرح می کند. امروزه بحران های انرژی و آلودگی محیط زیست تبدیل به معضل بزرگی برای بشر شده است. همچنین آلودگی های حاصل از سوختن ترکیبات نفتی مانند کربن منوکسید و کربن دی اکسید و… موجب ایجاد مسائل زیست محیطی از قبیل اثر گلخانه ای و آسیب دیدن لایه اوزون شده است. جهت رفع این مشکل تلاش های گسترده ای برای جایگزینی سوخت های فسیلی با سایر منابع انرژی صورت گرفته است که نتایج قابل قبولی نیز حاصل شده است. بخش اعظم مشکلات زیست محیطی ناشی از، تولید انرژی، تبدیل آن و استفاده نهایی می باشد که این عوامل به طرق مستقیم و یا غیر مستقیم مخاطرات و تبعات زیست محیطی را سبب می گردند. تولید انرژی با استفاده از ابزارهای تمیز و کارآمد و دوستدار طبیعت امروزه یکی از عمده ترین مباحث مورد مطالعه توسط دانشمندان و مهندسین می باشد. سلول های سوختی انرژی شیمیایی یک سوخت گازی را مستقیماً به کار الکتریکی تبدیل می کنند و به دلیل اینکه در این سلول ها هیچ احتراقی رخ نمی دهد بسیار تمیزتر و کارامدتر از موتورهای احتراق داخلی هستند. در سلول های سوختی تبدیل مستقیم انرژی شیمیایی به انرژی الکتریکی به وسیله واکنش شیمیایی اکسیژن یا اکسیدکننده های دیگر با سوخت هایی از جمله هیدروژن و هیدروکربن هایی مثل گاز طبیعی و متانول انجام می شود.
مقدمه
سلول سوختی دستگاه های الکتروشیمیایی هستند که انرژی شیمیایی یک سوخت را بدون عمل احتراق به انرژی الکتریکی تبدیل می کند. سوخت های متعارف به کار رفته در سلول های سوختی عبارتند از گاز هیدروژن، متانول، اتانول و … که با هوا (ترجیحاً اکسیژن) به عنوان اکسید کننده به صورت الکتروشیمیایی وارد فعل و انفعال شده و تا زمانی که سوخت و اکسیدان وجود دارد انرژی الکتریکی به صورت جریان مستقیم تولید می شود. اگرچه پيل سوختي اخیراً به عنوان يكي از راهكارهاي توليد انرژي الكتريكي مطرح شده است ولي تاريخچه آن به قرن نوزدهم و كار دانشمند انگليسي سرويليام گرو برمي گردد. او اولين پيل سوختي را در سال ١٨٣٩ با سرمشق گرفتن از واكنش الكتروليز آب، طي واكنش معكوس و در حضور كاتاليزور پلاتين ساخت (شکل1).
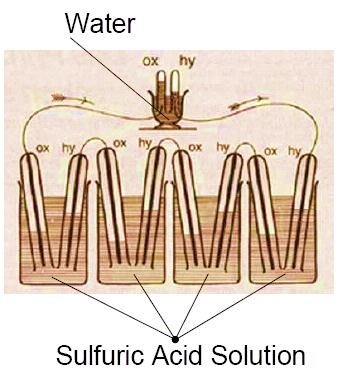
در این روش، گرو تیغه های پلاتینی را داخل لوله های غوطه ور در اسیدسولفوریک که از گازهای هیدروژن و اکسیژن پر شده اند قرار داد. تلاش هاي متعددي در اوايل قرن بيستم در جهت توسعه پيل سوختي انجام شد كه به دليل عدم درك علمي مسئله هيچ يك موفقيت آميز نبود و علاقه به استفاده از پيل سوختي با كشف سوخت هاي فسيلي ارزان و رواج موتورهاي بخار كمرنگ گرديد.
پيل سوختي يك سل الكتروشيميايي است كه در آن انرژي شيميايي سوخت و اكسيد كننده، مستقيماً به انرژي الكتريكي تبديل مي شود. ساختار كلي يك پيل سوختي از يك لايه الكتروليت كه در دو طرف آن الكترودهاي آند و كاتد متخلخل قرار گرفته، تشكيل شده است. در يك پيل سوختي، سوخت به صورت پيوسته در سمت آند (الكترود منفي) و اكسيد كننده در سمت كاتد (الكترود مثبت) تغذيه مي شود. سوخت و اكسيد كننده گازي بر روي آند و كاتد متخلخل در مجاورت الكتروليت با انجام واكنش اكسيداسيون و احياء، انرژي الكتريكي توليد مي كنند. در پيل هاي سوختي معمولاً هيدروژن گازي به عنوان سوخت و اكسيژن يا هوا به عنوان اكسيد كننده مصرف مي شوند. در اين صورت تنها محصول واكنش پيل سوختي، بخار آب خواهد بود (شکل2).
مزایا و معایب پیل سوختی
پیل های سوختی در مقایسه با سایر مولدهای نیرو از مزایای زیادی برخوردارند که به برخی از آنها اشاره می شود.
- کارائی بالا
- فاقد قسمتهای متحرک و در نتیجه نداشتن آلودگی های صوتی
- عدم انتشار گازهای آلوده کننده محیط زیست
- ساده بودن نسبی سیستم تعمیر و نگهداری
- طول عمر بالا
- کاهش مصرف سوخت
- اشغال فضای کم
- هزینه نگهداری پایین
در مقابل مزایای یادشده بزرگترین اشکال پیل های سوختی را می توان قیمت بالای آنها دانست که با بهره برداری از تکنولوژی های جدید این مشکل نیز قابل حل خواهدبود.
الکتروکاتالیست ها
الکتروکاتالیزورها موادی هستند که سرعت واکنش های الکتروشیمیایی را افزایش داده بدون آنکه خود در حین واکنش مصرف شود. خاصيت الكتروكاتاليزوري يكي از ويژگي هاي بارز الكترودهاي اصلاح شده است كه مدنظر دانشمندان در حوزه الكتروشيمي قرار گرفته است. اين ويژگي در يك الكترود اصلاح شده باعث كاهش پتانسيل مازاد و يا افزايش جريان احيايي يا اكسايشي گونه الكتروفعال می شود. الکتروکاتالیزورها مانند کاتالیزورها به دو دسته همگن و ناهمگن طبقه بندی می شوند. در الکتروکاتالیزورهای همگن واکنش انتقال الکترون در درون محلول انجام می گیرد و انتقال الکترون مستقیماً از الکترود به واکنشگرها منتقل نمی شوند ولی در الکتروکاتالیزورهای ناهمگن واکنشگرها به سطح الکترود آمده و انتقال الکترون بین دو فاز الکترود و محلول صورت می گیرد.
واکنش احیای اکسیژن
واکنش کاهش اکسیژن (ORR) احتمالاً مهمترین واکنش در فرآیندهای زندگی مانند تنفس بیولوژیکی و در سیستمهای تبدیل انرژی مانند پیل های سوختی و باتریهای هوا-فلز است. ORR در محلول های آبی عمدتاً توسط دو مسیر اتفاق می افتد: مسیر انتقال مستقیم چهار الکترون از O2 به H2O، و مسیر انتقال دو الکترون از O2 به پراکسید هیدروژن (H2O2). در حلالهای آپروتیک غیرآبی و/یا در محلولهای قلیایی، مسیر انتقال تکالکترون از O2 به سوپراکسید نیز میتواند رخ دهد. در سلولهای سوختی غشای تبادل پروتون (PEM) شامل پیلهای سوختی هیدروژن/اکسیژن و متانول/اکسیژن واکنش ORR در کاتد رخ میدهد. متأسفانه، سینتیک ORR به طور معمول بسیار کند است. به منظور سرعت بخشیدن به سینتیک ORR برای رسیدن به سطح قابل استفاده عملی در یک پیل سوختی، به یک کاتالیزور کاتدی ORR نیاز است.
در مرحله فعلی فناوری، مواد مبتنی بر پلاتین (Pt) کاربردی ترین کاتالیزورها هستند. کاتالیزور پلاتین با وجود اینکه سینتیک تندی برای احیای اکسیژن دارند ولی برای استفاده های صنعتی و مقیاس بزرگ این کاتالیزور مطلوب نیست. به مرور زمان فعالیت کاتالیزوری پلاتین تغییر می کند همچنین در حضور متانول انتخابگری برای واکنش احیای اکسیژن ندارد و در حضور گاز منوکسیدکربن کاتالیزور پلاتین مسموم می شود و مهمتر از همه موارد ذکر شده، قیمت بالای این کاتالیزور است که باعث محدودیت های برای استفاده های صنعتی و مقیاس بزرگ شده است. به خاطر همین دلایل ذکر شده دانشمندان و محققین به دنبال یافتن کاتالیزورهای با قیمت پایین، پایدار و دارای سینتیک تند برای واکنش احیای اکسیژن هستند. مواد کربنی به علت داشتن برخی ویژگی های مطلوب و پایدار و قیمت پایین به عنوان الکترود کاتد برای واکنش احیای اکسیژن استفاده می شوند. از آنجایی که این کاتالیزورهای مبتنی بر پلاتین برای ساخت پیلهای سوختی تجاری بسیار گران هستند، تحقیقات گسترده در چندین دهه گذشته بر روی توسعه کاتالیزورهای جایگزین، از جمله کاتالیزورهای فلزات غیر نجیب متمرکز شده است. این کاتالیست ها شامل مواد کربنی، ترکیبات ماکروسیکلیک فلزات واسطه، کالکوژنیدهای فلزات واسطه، و کاربیدهای فلزات واسطه است.
طبقه بندی پیل های سوختی
پیل های سوختی بسته به نوع الکترولیت به کار رفته در آنها به پنج گروه مختلف تقسیم می شوند که عبارتند از:
- پیل سوختی قلیایی (AFC): Alkaline fuel cell
- پیل سوختی غشای پلیمری (PEMFC): polymeric-electrolyte-membrane fuel cell
- پیل سوختی فسفریک اسید (PAFC) : phosphoric-acid fuel cell
- پیل سوختی کربنات مذاب (MCFCs): molten-carbonate fuel cells
- پیل سوختی اکسید جامد (SOFCs) : solid-oxide fuel cells
به دلیل ماهیت واکنش های انجام شده در آند و کاتد، این واکنش ها بر روی کاتالیزور انجام می گیرد. تحقیقات انجام گرفته نشان می دهند که اکثر کاتالیزورهای به کار رفته از جنس فلزات نجیب و آلیاژهای آن ها می باشند که با توجه به قیمت بالای آن ها بهینه کردن مقدار کاتالیزور بدون کاهش عملکرد پیل از اهمیت زیادی برخوردار است.
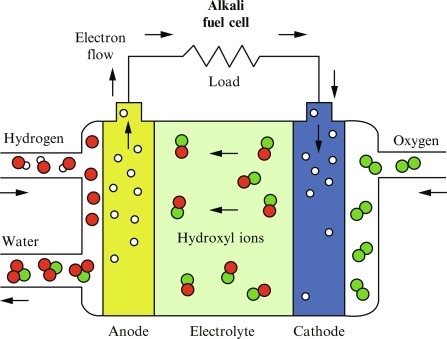
پیل های سوختی قلیایی با هیدروژن و اکسیژن فشرده کار می کنند. آنها معمولاً از محلول هیدروکسید پتاسیم (از نظر شیمیایی، KOH) در آب به عنوان الکترولیت خود استفاده می کنند. راندمان حدود 70 درصد و دمای عملیاتی 150 تا 200 درجه سانتیگراد (حدود 300 تا 400 درجه فارنهایت) است. محدوده خروجی سلول از 300 وات (W) تا 5 کیلووات (کیلووات) است. سلول های قلیایی در فضاپیمای آپولو برای تامین برق و آب آشامیدنی استفاده شد. با این حال، آنها به سوخت هیدروژن خالص نیاز دارند و کاتالیزورهای الکترود پلاتین آنها گران هستند. و مانند هر ظرف پر از مایع، ممکن است نشت کنند.

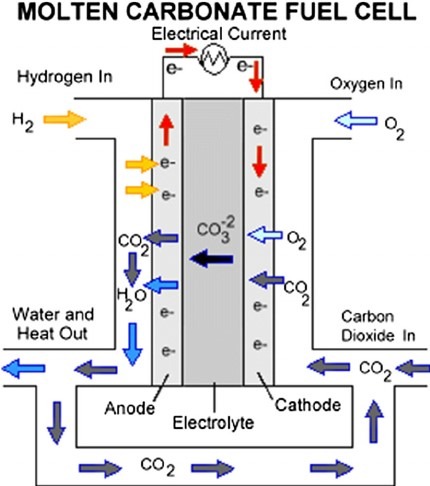
سلول های سوختی کربنات مذاب (MCFC) از ترکیبات کربنات نمک (مانند سدیم یا منیزیم) با دمای بالا (از نظر شیمیایی، CO3) به عنوان الکترولیت استفاده می کنند. راندمان از 60 تا 80 درصد متغیر است و دمای کار حدود 650 درجه سانتیگراد (1200 درجه فارنهایت) است. واحدهایی با توان خروجی تا 2 مگاوات (MW) ساخته شده اند و طرح هایی برای واحدهای تا 100 مگاوات وجود دارد. دمای بالا آسیب ناشی از “مسمومیت” مونوکسید کربن سلول را محدود می کند و گرمای هدر رفته را می توان برای تولید برق اضافی بازیافت کرد. کاتالیزورهای الکترود نیکل آنها در مقایسه با پلاتین مورد استفاده در سلول های دیگر ارزان هستند. اما دمای بالا همچنین مواد و استفاده ایمن از MCFC ها را محدود می کند – آنها احتمالاً برای استفاده خانگی خیلی گرم خواهند بود. همچنین یونهای کربنات الکترولیت در واکنشها مصرف میشوند و برای جبران نیاز به تزریق دیاکسید کربن است.
سلول های سوختی اسید فسفریک (PAFC) از اسید فسفریک به عنوان الکترولیت استفاده می کنند. راندمان بین 40 تا 80 درصد و دمای عملیاتی بین 150 تا 200 درجه سانتیگراد (حدود 300 تا 400 درجه فارنهایت) است. سلول های اسید فسفریک موجود تا 200 کیلووات خروجی دارند و واحدهای 11 مگاواتی آزمایش شده اند. PAFC ها غلظت مونوکسید کربن حدود 1.5 درصد را تحمل می کنند که انتخاب سوخت هایی را که می توانند استفاده کنند گسترده تر می کند. در صورت استفاده از بنزین، گوگرد باید حذف شود. کاتالیزورهای الکترود پلاتین مورد نیاز است و قطعات داخلی باید قادر به مقاومت در برابر اسید خورنده باشند.

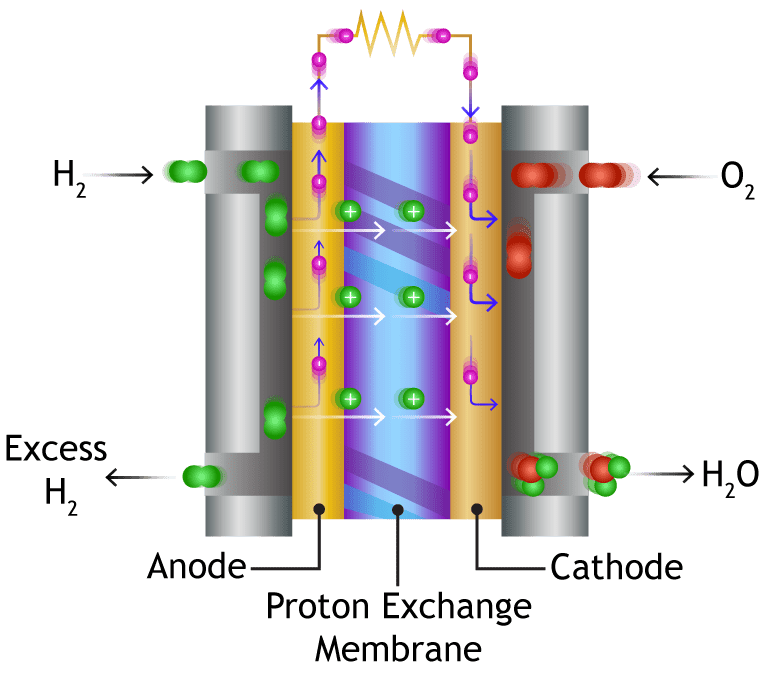
سلول های سوختی غشای تبادل پروتون (PEM) با یک الکترولیت پلیمری به شکل یک صفحه نازک و نفوذپذیر کار می کنند. راندمان حدود 40 تا 50 درصد و دمای کار حدود 80 درجه سانتیگراد (حدود 175 درجه فارنهایت) است. خروجی سلول معمولاً بین 50 تا 250 کیلو وات است. الکترولیت جامد و انعطاف پذیر نشت نمی کند و ترک نمی خورد و این سلول ها در دمای کافی پایین کار می کنند تا برای خانه ها و اتومبیل ها مناسب باشند. اما سوخت آنها باید خالص شود و از یک کاتالیزور پلاتین در دو طرف غشا استفاده می شود که هزینه ها را بالا می برد.
پیلهای سوختی اکسید جامد (SOFC) از ترکیب سخت و سرامیکی اکسیدهای فلزی (مانند کلسیم یا زیرکونیوم) (از نظر شیمیایی، O2) به عنوان الکترولیت استفاده میکنند. راندمان حدود 60 درصد و دمای عملیاتی حدود 1000 درجه سانتیگراد است. خروجی سلول ها تا 100 کیلو وات است. در چنین دماهای بالایی نیازی به اصلاح کننده برای استخراج هیدروژن از سوخت نیست و گرمای هدر رفته را می توان برای تولید برق اضافی بازیافت کرد. با این حال، دمای بالا کاربردهای واحدهای SOFC را محدود میکند و نسبتاً بزرگ هستند. در حالی که الکترولیت های جامد نمی توانند نشت کنند، ممکن است ترک بخورند.

چرا ردوکس کالا؟
ردوکس کالا با تیم متخصص در زمینه نانومواد و انرژی بهترین محصولات مورد نیاز شما را تامین می کند.
ردوکس کالا صرفا فروشنده نیست و کالاهای مورد نیاز پژوهشگران را با دانش تخصصی تیم خود تامین می کند.
محصولات ردوکس کالا قبل از فروش به مشتری توسط کارشناسان تست می شود این به این معنی است که شما با خیال آسوده از عملکرد محصولات می توانید محصولات را تهیه کنید.







